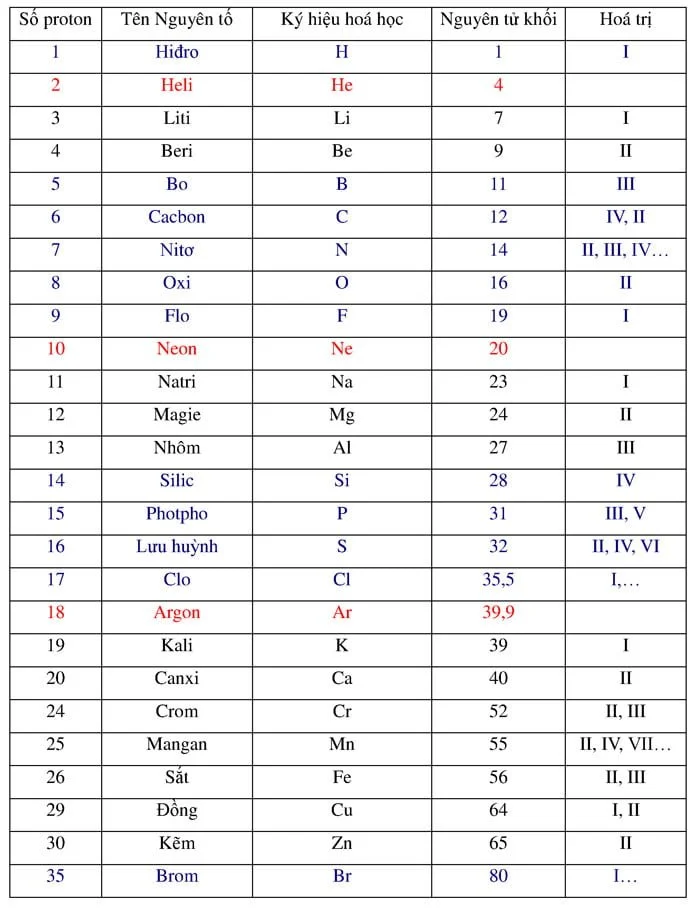
Các công thức hóa học cần nhớ chọn lọc để giải nhanh bài tập: công thức tính thể tích dung dịch, công thức tính khối lượng muối, công thức tính khối lượng kim loại…

Các công thức hóa học dùng giải nhanh bài tập
1. Công thức tính số đồng phân este đơn chức no mạch hở: CnH2nO2
Số đồng phân CnH2n = 2n-2 (1< n < 5).
Ví dụ: Số đồng phân của este đơn chức no, mạch hở có công thức phân tử C2H4O2 là 22-2 = 1
2. Công thức tính số đồng phân amin đơn chức no mạch hở CnH2n+3N:
Số đồng phân CnH2n+3N = 2n-1 (n < 5).
Ví dụ: Số đồng phân của amin đơn chức no, mạch hở có công thức phân tử C2H7N là 22-1 = 1
3. Công thức tính số trieste (triglixerit) tạo ra bởi glixerol và hỗn hợp n axit béo
Số trieste = ![]()
Ví dụ: Đun nóng hỗn hợp gồm glixerol với hai axit béo là axit panmitic và axit stearic (xúc tác H2SO4 đặc) thì thu được bao nhiêu trieste?
Số trieste = ![]() = 6
= 6
4. Công thức tính số đi, tri, tetra…n peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau:
Số n peptitmax = Xn
Ví dụ: Có tối đa bao nhiêu đipeptit, tripeptit thu được từ hỗn hợp gồm 2 amino axit là glyxin và alalin?
Số đipeptit = 22 = 4
Số tripeptit = 23 = 8
5. Công thức tính khối lượng amino axit A (Chứa n nhóm -NH2 và m nhóm COOH) khi cho amino axit này vào dung dịch chứa a mol HCL, sau đó cho dung dụng sau phản ứng tác dụng vừa đủ với b mol NaOH.
![]()
Ví dụ: Cho m gam glyxin vào dung dịch chứa 0.3 mol HCL. Dung dịch sau phản ứng tác dụng vừa đủ với 0.5 mol NaOH. Tìm m? (MGlyxil = 75)
![]() = 17.8 gam
= 17.8 gam
7. Công thức tính khối lượng muối clorua khi cho kim loại tác dụng với dung dịch HCL giải phóng khí H2
mMuối clorua = mKL + 71.nH2
Ví dụ: Cho 10 gam hỗn hợp kim loại gồm Mg, Al, Zn tác dụng với dung dịch H2SO2 loãng thu được 2.2 lít khí H2 (đktc). Tính khối lượng muối thu được?
mMuối clorua = mKL + 96.nH2 = 10 + 96.0.1 = 19.6 gam
9. Công thức tính khối lượng muối sunphat khi cho kim loại tác dụng với dung dịch H2SO4 đặc tạo sản phẩm khử SO2, S, H2S và H2O
mMuối sunphat = mKL + 96/2(2nSO2 + 6nS + 8nH2S) = mKL + 96(nSO2 + 3nS + 4nH2S)
Lưu ý: Sản phẩm khử nào không có thì bỏ qua.
nH2SO4 = 2nSO2 + 4nS + 5nH2S
10. Công thức tính khối lượng muối nitrat khi cho kim loại tác dụng với dung dịch HNO3 giải phóng khí: NO2, NO, N2O, NH4NO3
mMuối Nitrat = mKL + 62(nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3)
Lưu ý: Sản phẩm khử nào không có thì bỏ qua.
nHNO3 = 2NO2 + 4NO + 10N2O + 12N2 + 10NH4NO3
11. Công thức tính khối lượng muối clorua khi cho muối cacbonat tác dụng với dung dịch HCL giải phóng khí CO2 và H2O
mMuối clorua = mMuối cacbonat + 11.nCO2
12. Công thức tính khối lượng muối sunfat khi cho muối cacbonat tác dụng với dung dịch H2SO4 loãng giải phóng khí CO2 và H2O
mMuối sunfat = mMuối cacbonat + 36.nCO2
13. Công thức tính khối lượng muối clorua khi cho muối sunfit tác dụng với dung dịch HCL giải phóng khí SO2 và H2O
mMuối clorua = mMuối sunfit – 9nSO2
14. Công thức tính số mol oxi trong oxit khi cho oxit tác dụng với dung dịch axit tạo muối và H2O
nO(Oxit) = nO(H2O) = 1/2nH(Axit)
15. Công thức tính khối lượng muối sunfat khi cho oxit kim loại tác dụng với dung dịch H2SO4 loãng tạo muối sunfat và H2O
Oxit + dd H2SO4 loãng —> Muối sunfat + H2O
mMuối sunfat = mOxit + 80nH2SO4
16. Công thức tính khối lượng muối clorua khi cho oxit kim loại tác dụng với dung dịch HCL tạo muối clorua và H2O
Oxit + dd HCL —> Muối clorua + H2O
mMuối clorua = mOxit + 55nH2O = mOxit + 27,5
17. Công thức tính khối lượng kim loại khi cho oxit kim loại tác dụng với các chất khử như: CO, H2
mKL = mOxit – mO(Oxit)
nO(Oxit) = nCO = nH2 = nCO2 = nH2O
18. Công thức tính lượng kết tủa xuất hiện khi hấp thụ hết một lượng CO2 vào dung dịch Ca(OH)2 hoặc Ba(OH)2
nKết tủa = nOH– – nCO2 (Với nKết tủa nhỏ hơn hoặc bằng nCO2 hoặc đề cho dung dịch bazơ phản ứng hết)
Ví dụ: Hấp thụ hết 11,2 lít CO2 (đktc) vào 350 ml dung dịch Ba(OH)2 1M (vừa đủ). Tính kết tủa thu được?
Ta có:
nCO2 = 0,5 mol
nBa(OH)2 = 0,35 mol -> nOH– = 0,7 mol
nKết tủa = nOH– – nCO2 = 0,7 – 0,5 = 0,2 mol
mKết tủa = 0,2.197 = 39,4 (g)
19. Công thức tính thể tích CO2 cần hấp thụ hết vào một dung dịch Ca(OH)2 hoặc Ba(OH)2 để thu được một lượng kết tủa theo yêu cầu.
Ta có 2 kết quả:
nCO2 = nKết tủa
nCO2 = nOH– – nKết tủa
Ví dụ: Hấp thụ hết V lít CO2 (đktc) vào 300 ml dung dịch và Ba(OH)2 1M thu được 19,7 gam kết tủa. Tính V?
Hướng dẫn giải:
nCO2 = nKết tủa = 0,1 mol => VCO2 = 2,22 lít
nCO2 = nOH– – nKết tủa = 0,6 – 0,1 = 0,5 => VCO2 = 11,2 lít
20. Công thức tính thể tích dung dịch NaOH cần cho vào dung dịch Al3+ để xuất hiện một lượng kết tủa theo yêu cầu
Ta có 2 kết quả:
nOH– min = 3.nKết tủa
nOH– = 4.nAl3+ – nKết tủa
Ví dụ: Cần cho bao nhiêu lít dung dịch NaOH 1M vào dung dịch chứa 0,5 mol AlCl3 để được 31,2 gam kết tủa?
Hướng dẫn giải:
Ta có 2 kết quả:
nOH– = 3.nKết tủa = 3.0,4 = 1,2 mol => V = 1,2 lít
nOH– = 4.nAl3+ – nKết tủa = 4.0,5 – 0,4 = 1,6 mol => V = 1,6 lít
21. Công thức tính thể tích dung dịch NaOH cần cho vào hỗn hợp dung dịch Al3+ và H+ để xuất hiện một lượng kết tủa theo yêu cầu.
Ta có 2 kết quả:
nOH– min = 3.nKết tủa + nH+
nOH– max = 4.nAl3+ – nKết tủa + nH+
Ví dụ: Cần cho bao nhiêu lít dung dịch NaOH 1M lớn nhất vào dung dịch chứa đồng thời 0,6 mol AlCL3 và 0,2 mol HCL để được 39 gam kết tủa?
Hướng dẫn giải:
nOH– max = 4.nAl3+ – nKết tủa + nH+ = 4.0,6 – 0,5 + 0,2 = 2,1 mol => V = 2,1 lít
22. Công thức tính thể tích dung dịch HCL cần cho vào dung dịch NaAlO2 để xuất hiện một lượng kết tủa theo yêu cầu.
Ta có 2 kết quả:
nH+ = nKết tủa
nH+ = 4.nAlO2– – 3.nKết tủa
Ví dụ: Cần cho bao nhiêu lít dung dịch HCL 1M vào dung dịch chứa 0,7 mol NaAlO2 để thu dduowwcj 39 gam kết tủa?
Hướng dẫn giải:
Ta có 2 kết quả:
nH+ = nKết tủa = 0,5mol => V = 0,5 lít
nH+ = 4.nAlO2– – 3.nKết tủa = 4.0,7 – 3.0,5= 1,3 mol => V = 1,3 lít
23. Công thức tính thể tích dung dịch NaOH cần cho vào hỗn hợp dung dịch Zn2+ để xuất hiện một lượng kết tủa theo yêu cầu.
Ta có 2 kết quả:
nOH– min = 2.nKết tủa
nOH– max = 4.nZn2+ – 2.nKết tủa
Ví dụ: Tính thể tích dung dịch NaOH 1M cần cho vào 200 ml dung dịch ZnCl2 2M để được 29,7 gam kết tủa.
Hướng dẫn giải:
Ta có nZn2+ 0,4 mol ; nKết tủa = 0,3 mol
nOH– min = 2.nKết tủa = 2.0,3 = 0,6 => Vdd NaOH = 0,6 lít
nOH– max = 4.nZn2+ – 2.nKết tủa = 4.0,4 – 2.0,3 = 1 mol => Vdd NaOH = 1 lít
Sotayhoctap chúc các bạn học tốt!