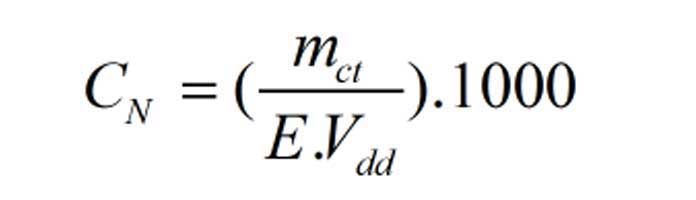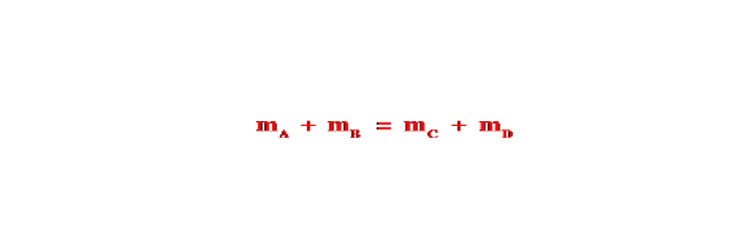Công thức tính phần trăm, công thức tính phần trăm khối lượng, công thức tính thành phần phần trăm, công thức tính nồng độ dung dịch hay công thức tính thành phần phần trăm theo khối lượng.
Hướng dẫn áp dụng công thức tính phần trăm
Khi biết công thức của hợp chất đã cho học sinh có thể tính thành phần phần trăm dựa vào khối lượng của các nguyên tố trong hợp chất đó với những bước sau:
Bước 1: Tính khối lượng mol của hợp chất AxBy:
Bước 2: Tính số mol nguyên tử của mỗi nguyên tố có chứa trong 1 mol hợp chất AxBy. 1 mol phân tử AxBy có: x mol nguyên tử A và y mol nguyên tử B.
– Tính khối lượng các nguyên tố chứa trong 1 mol hợp chất AxBy.
mA=x.MA
mB=y.MB
– Thực hiện tính phần trăm theo khối lượng của mỗi nguyên tố theo công thức:
%mA= mA/mAxBy.100%= .100%
%B= mB/mAxBy.100%= .100%
Hoặc %mB=100%-%mA
Công thức tính phần trăm khối lượng
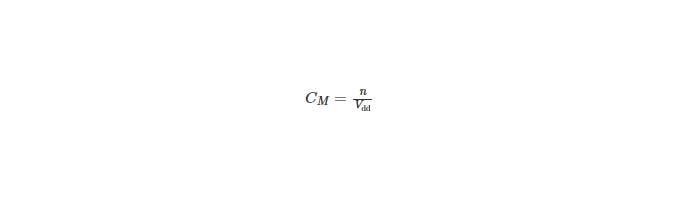
Công thức tính nồng độ mol /lít (CM)
CM =n/V (M)
Trong đó:
– n: số mol chất tan trong dung dịch (mol)
– V: thể tích dung dịch (lít)
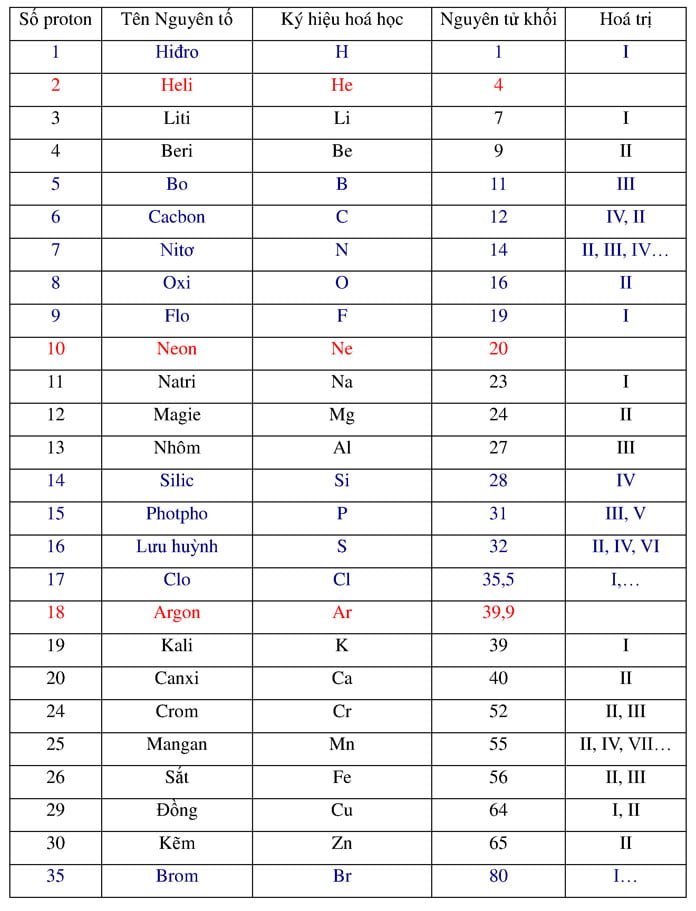
Công thức tính nồng độ phần trăm (C%)
![]()
mct: Khối lượng chất tan
mdd: Khối lượng dung dịch
Công thức tính thành phần phần trăm
Phần trăm theo khối lượng
![]()
Trong đó:
mhỗn hợp= mA + mB + mC +…
Phần trăm theo thể tích(Chính là phần trăm theo số mol)
![]()
Trong đó:
nhỗn hợp= nA + nB + nC +…
Công thức tính khối lượng riêng(D)
![]()
Công thức liên hệ C%, CM, Khối lượng riêng D
![]()
Ví dụ áp dụng công thức tính phần trăm khối lượng
Ví dụ 1: Tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất sau:
a)SO2
b)Fe2(SO4)3
Lời giải:
a) MSO2=32+16.2=64
1 mol SO2có 1 mol S và 2 mol O
%S= mS/mSO2.100%= .100%=50%
%O= 100%- %mS= 100%-50%=50%
b)M Fe2(SO4)3=56.2+(32+16.4).3=400
1 mol Fe2(SO4)3 có chứa 2 mol Fe, 12 mol O, 3 mol S
%mFe= mFe/400.100%= .100%=24%
%mS= mS/400.100%=24%
%mO= mO/400.100%=48%
Ví dụ 2: Một loại phân bón hóa học có thành phần chính là KNO3 ( K=39; N=14; O=16 )
Hãy tính phần trăm: %mK = ? ; %mN = ? ; %mO = ?
Lời giải:
+ Tính khối lượng Mol (M) của hợp chất : M KNO3= 39+14+(3.16)= 101
+ Trong 1 mol KNO3: có 1 mol nguyên tử K;3 mol nguyên tử O; 1 mol nguyên tử N
( Nói cách khác trong 101g KNO3: có 39 g K; 14 g N và 3. 16 g O)
+ Tính thành phần phần trăm các nguyên tố có trong hợp chất Fe2(SO4)3
%mO ≈ 100%-(38,6%+13,8%)= 47,6%
Sotayhoctap chúc các bạn học tốt!