Mẹo ghi nhớ nhanh dãy hoạt dộng hóa học của kim loại đầy đủ: dãy hoạt dộng hóa học của kim loại và ý nghĩa, cách nhớ dãy hoạt dộng hóa học của kim loại…

Dãy hoạt dộng hóa học của kim loại là gì?
– Dãy hoạt động hóa học của kim loại là dãy các kim loại được sắp xếp theo chiều giàm dần mức độ hoạt động hóa học của chúng.
– Dãy hoạt động hoá học của kim loại cho biết:
- Mức độ hoạt động hoá học của các kim loại giảm dần trừ trái sang phải
- Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí H2
- Kim loại đứng trước H phản ứng với một số dung dịch Axit (HCl, H2SO4 loãng,…) giải phóng khí H2
- Kim loại đứng trước (trừ Na K,…) đẩy kim loại đứng sau ra khỏi dung dịch muối
Mẹo nhớ dãy hoạt dộng hóa học của kim loại
Cách nhớ nhanh dãy hoạt động hóa học của kim loại
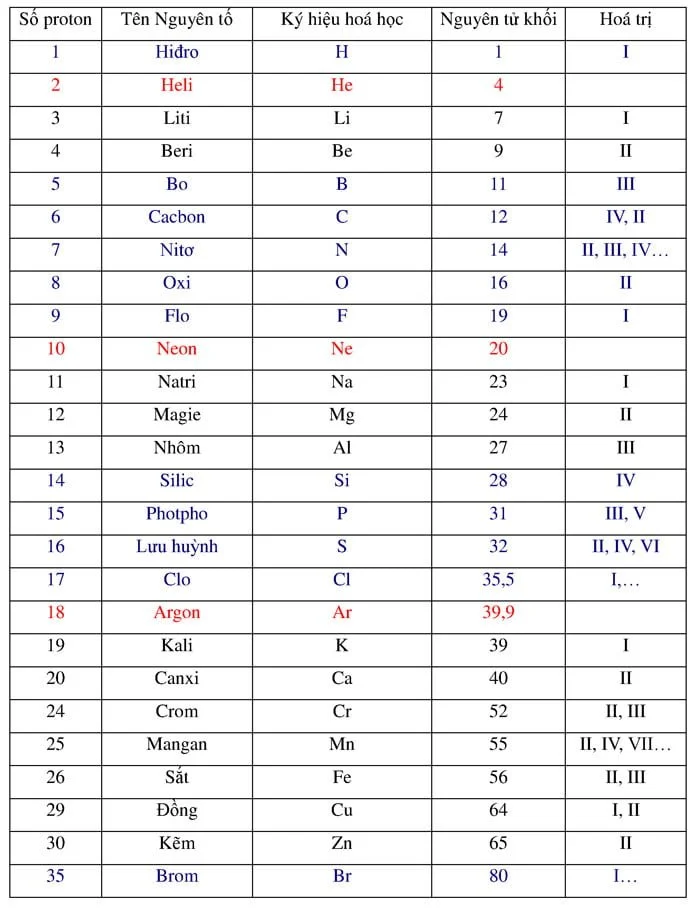
Dãy hoạt động hoá học của kim loại : K Na Ca Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au.
Cách nhớ: “Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Áo Phi Âu”
Các nguyên tố phân nhóm chính
Nhóm IA: Li – Na – K – Rb – Cs – Fr: Lâu nay không rảnh coi phim.
Nhóm II: Be-Mg-Ca-Sr-Ba-Ra: Bé Mang Cây Súng Bắn Ruồi
Nhóm IIA: Be Mg Ca Sr Ba Ra: Banh Miệng, Cá, Sấu, Bẻ, Răng.
Nhóm IIIA : B Al Ga In Ti: Bà, Anh lấy , Gà , Trong , Tủ lạnh.
Nhóm IVA: C Si Ge Sn Pb: Chú , Sỉ , Gọi em , Sang nhậu , Phở bò.
Nhóm VA : N P As Sb Bi: Ni cô , Phàm tục , Ắc , Sầu , Bi.
Nhóm VIA: O S Se Te Po: Ông , Say , sỉn , té , bò.
Nhóm VIIA : F Cl Br I At: Phải , Chi , Bé , Iêu , anh.
Nhóm VIIIA : He Ne Ar Kr Xe Rn: Hằng , Nga , Ăn , Khúc , Xương , Rồng.
Ý nghĩa của dãy hoạt động hóa học của kim loại
a. Mức độ hóa học của các kim loại giảm dần từ trái sang phải
=> K là kim loại hoạt động mạnh nhất và Au là kim loại hoạt động kém nhất.
b. Kim loại đứng trước Mg (K, Ba, Ca, Na) phản ứng được với nước ở nhiệt độ thường
2 Na + 2H2O → 2NaOH + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
c. Kim loại đứng trước H tác dụng với dung dịch axit (HCl; H2SO4 loãng,….) tạo ra H2
Fe + 2HCl → FeCl2 + H2 ↑
Cu + 2HCl → không phản ứng (vì Cu đứng sau H)
d. Kim loại không tan trong nước (từ Mg trở về sau) đẩy được kim loại đứng sau nó ra khỏi dung dịch muối
Fe + CuSO4 → FeSO4 + Cu
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Chú ý:Khi cho Na vào dung dịch CuCl2 thì:
+ Na phản ứng với nước trước: 2Na + 2H2O → 2NaOH + H2↑
+ Sau đó xảy ra phản ứng: CuCl2 + 2NaOH → Cu(OH)2↓ + 2Ag
Sotayhoctap chúc các bạn học tốt!