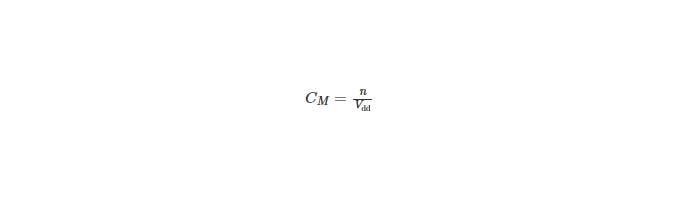
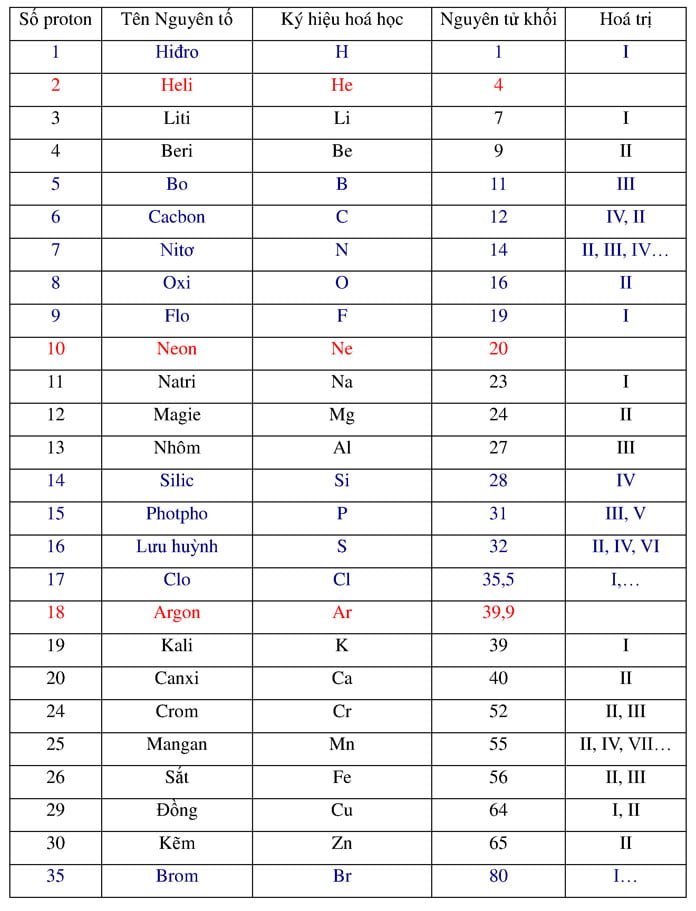
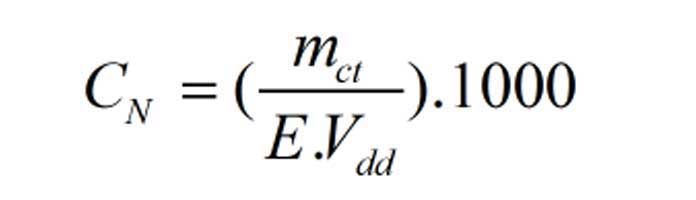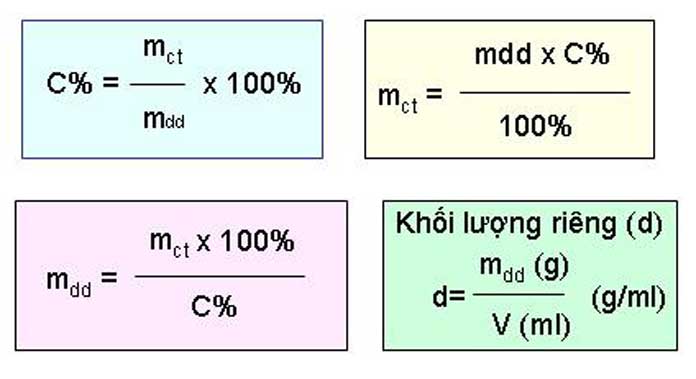Bài viết định luật bảo toàn khối lượng bao gồm: định luật bảo toàn khối lượng là gì, cách áp dụng định luật bảo toàn khối lượng, phương pháp bảo toàn khối lượng giải nhanh hóa học…
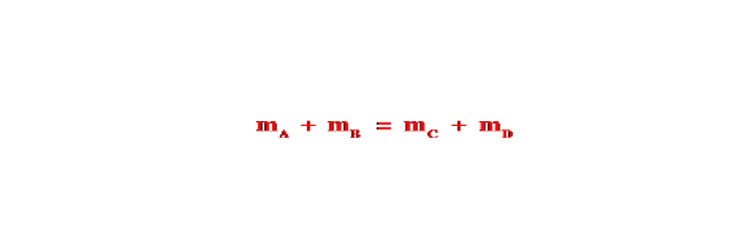
Định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng là gì?
Định luật bảo toàn khối lượng hay định luật Lomonosov – Lavoisier là một định luật cơ bản trong lĩnh vực hóa học, được phát biểu như sau:
Trong phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các sản phẩm tạo thành.
Giả sử có phản ứng giữa A + B tạo ra C + D có công thức khối lượng được viết như sau :
mA + mB = mC + mD
Ví dụ: Bari clorua +natri sunphat bari sunphat + natri clorua. Có công thức khối lượng là:
mbari clorua + mnatri sunphat = mbari sunphat + mnatri clorua
Cách áp dụng định luật bảo toàn khối lượng
Trong một phản ứng có n chất, nếu biết khối lượng của (n – 1) chất thì tính được khối lượng của chất còn lại.
Ý nghĩa của định luật bảo toàn khối lượng: Khối lượng các chất sản phẩm phản ứng bằng khối lượng các chất phản ứng.
Chú ý:
Không tính khối lượng của phần không tham gia phản ứng cũng như phần chất có sẵn, ví dụ nước của dung dịch.
Khi cô cạn dung dịch thì khối lượng muối thu được bằng tổng khối lượng các cation kim loại và anion gốc axit.
Để vận dụng định luật bảo toàn khối lượng, các bạn nên nhớ các kiến thức dưới đây để giải bài tập cho hiệu quả:
Kim loại + axit không có tính oxi hóa mạnh như HCl, H2SO4 loãng thì:
Số mol HCl phản ứng = 2 số mol H2 sinh ra
Số mol H2SO4 phản ứng = số mol H2 sinh ra
Khối lượng muối = khối lượng kim loại + khối lượng gốc axit
Oxit kim loại + axit không có tính oxi hóa mạnh như HCl, H2SO4 loãng
Số mol HCl phản ứng = 2 số mol H2O sinh ra
Số mol H2SO4 phản ứng = số mol H2O sinh ra
Số mol O trong oxit = số mol H2O sinh ra
Oxit kim loại + CO → kim loại + CO2
Số mol O trong oxit = số mol CO = số mol CO2
Kim loại + H2O → Bazo + H2
Số mol OH– = 2 số mol H2 thoát ra
Nếu kim loại hóa trị I thì: số mol kim loại = số mol OH–
Nếu kim loại hóa trị II thì: số mol kim loại = số mol H2
Phương pháp bảo toàn khối lượng giải nhanh hóa học
Nội dung phương pháp
Phương pháp bảo toàn khối lượng cho phép giải nhanh được nhiều bài toán khi biết quan hệ về khối lượng của các chất trước và sau phản ứng.
Đặc biệt, khi chưa biết rõ phản ứng xảy ra hoàn toàn hay không hoàn toàn thì việc sử dụng phương pháp này càng giúp đơn giản hóa bài toán hơn.
Phương pháp bảo toàn khối lượng thường được sủ dụng trong các bài toán nhiều chất.
– Áp dụng định luật bảo toàn khối lượng: “ Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các chất sản phẩm”
Điều này giúp ta giải bài toán hóa học một cách đơn giản, nhanh chóng
Xét phản ứng: A + B → C + D
Ta luôn có: mA + mB = mC + mD
* Lưu ý: Điều quan trọng nhất khi áp dụng phương pháp này đó là việc phải xác định đúng lượng chất (khối lượng) tham gia phản ứng và tạo thành (có chú ý đến các chất kết tủa, bay hơi, đặc biệt là khối lượng dung dịch).
Nội dung phương pháp bảo toàn khối lượng
Hệ quả 1: Biết tổng khối lượng chất ban đầu ⇔ khối lượng chất sản phẩm
Phương pháp giải: m(đầu) = m(sau) (không phụ thuộc hiệu suất phản ứng)
Hệ quả 2: Trong phản ứng có n chất tham gia, nếu biết khối lượng của (n – 1) chất thì ta dễ dàng tính khối lượng của chất còn lại.
Hệ quả 3: Bài toán: Kim loại + axit → muối + khí
mmuối = mkim loại + manion tạo muối
– Biết khối lượng kim loại, khối lượng anion tạo muối (tính qua sản phẩm khí) → khối lượng muối
– Biết khối lượng muối và khối lượng anion tạo muối → khối lượng kim loại
– Khối lượng anion tạo muối thường được tính theo số mol khí thoát ra:
· Với axit HCl và H2SO4 loãng
+ 2HCl → H2 nên 2Cl– ⇔ H2
+ H2SO4 → H2 nên SO42- ⇔ H2
· Với axit H2SO4 đặc, nóng và HNO3: Sử dụng phương pháp ion – electron (xem thêm phương pháp bảo toàn electron hoặc phương pháp bảo toàn nguyên tố)
Hệ quả 3: Bài toán khử hỗn hợp oxit kim loại bởi các chất khí (H2, CO)
Sơ đồ: Oxit kim loại + (CO, H2) → rắn + hỗn hợp khí (CO2, H2O, H2, CO)
Bản chất là các phản ứng: CO + [O] → CO2
H2 + [O] → H2O
=> n[O] = n(CO2) = n(H2O) -> mrắn = mOxit – m[O]
Các bước giải
– lập sơ đồ biến đổi các chất trước và sau phản ứng.
Từ giả thiết của bài toán tìm ![]() (không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
(không cần biết phản ứng là hoàn toàn hay không hoàn toàn)
– Vận dụng định luật bảo toàn khối lượng để lập phương trình toán học, kết hợp dữ kiện khác để lập hệ phương trình toán.
– Giải hệ phương trình.
Bài tập về định luật bảo toàn khối lượng
Ví dụ 1: Trong phản ứng hóa học : bari clorua + natri sunphat bari sunphat + natri clorua. Cho biết khối lượng của natri sunphat Na2SO4 là 14,2 gam, khối lượng của bari sunphat BaSO4 và natri clorua NaCl lần lượt là : 23,3 g và 11,7 g.
Hãy tính khối lượng của bari clorua BaCl2 đã phản ứng?
Hướng dẫn:
Áp dụng định luật bảo toàn khối lượng (BTKL)
mbari clorua + mnatri sunphat = mbari sunphat + mnatri clorua
<-> mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl
-> mBaCl2 = mBaSO4 + mNaCl – mNa2SO4
-> mBaCl2 = 23,3 + 11,7 – 14,2 = 20,8 (g)
Ví dụ 2: Đốt cháy hết 9 gam kim loại magie Mg trong không khí thu được 15 g hỗn hợp chất magie oxit MgO. Biết rằng magie cháy là xảy ra phản ứng với oxi O2 trong không khí.
a. Viết phản ứng hóa học trên.
b. Viết công thức về khối lượng của phản ứng xảy ra.
c. Tính khối lượng của khí oxi phản ứng.
Hướng dẫn:
a. Phản ứng hóa học: Magie + Oxi -> Magie oxit
b. mMg + mO2 = mMgO
c. Khối lượng của Oxit tham gia phản ứng là:
mO2 = mMgO – mMg = 15 – 9 = 6g
Ví dụ 3: Đốt cháy m(g) cacbon cần 16g oxi thì thu được 22 gam khí cacbonic. Tính m?
Hướng dẫn:
Theo định luật bảo toàn khối lượng: mC + mO2 = mCO2 -> mC = mCO2 – mO2 = 22 – 16 = 6g
Vậy m=6g
Ví dụ 4: Đốt cháy 3,2g lưu huỳnh S trong không khí thu được 6,4g lưu huỳnh đioxit. Tính khối lượng của oxi đã phản ứng.
Hướng dẫn:
Theo định luật bảo toàn khối lượng: mS + mO2 = mSO2 -> mO2 = mSO2 – mS = 6,4 – 3,2 = 3,2g
Sotayhoctap chúc các bạn học tốt!