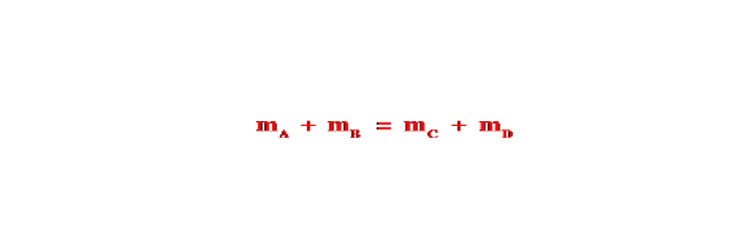Bài viết tính chất hóa học của muối bao gồm: tính chất hóa học của muối và điều kiện, phản ứng trao đổi trong dung dịch, ví dụ bài tập về muối và phản ứng trao đổi…
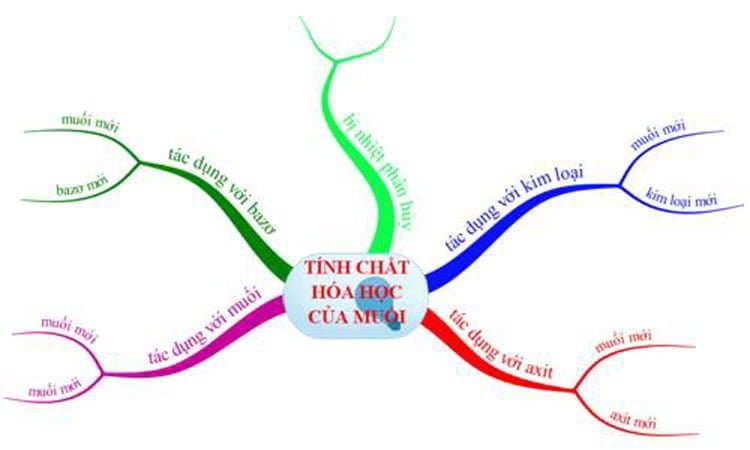
I. Tính chất hóa học của muối và điều kiện
1. Tính chất hóa học của muối tác dụng với kim loại
Muối + Kim loại → Muối mới + Kim loại mới
Điều kiện : Kim loại ban đầu phải đứng sau Mg và đứng trước kim loại trong muối (Tính theo dãy hoạt động hóa học của kim loại)
Ví dụ:
Fe + CuSO4 → FeSO4 + Cu↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
2. Tính chất hóa học của muối tác dụng với axit
Muối + Axit → Muối mới + Axit mới
Điều kiện: trong sản phẩm tạo thành phải có chất kết tủa hoặc chất bay hơi.
Ví dụ:
BaCl2 + H2SO4 → 2HCl + BaSO4↓
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
(axit mới là H2CO3 là một chất dễ phân hủy tạo ra CO2 và H2O)
3. Tính chất hóa học của muối tác dụng với dung dịch muối
Muối + Muối → Muối mới + Muối mới
Điều kiện: trong sản phẩm tạo thành phải có chất kết tủa hoặc chất bay hơi.
Ví dụ:
AgNO3 + NaCl → NaNO3 + AgCl↓
4. Tính chất hóa học của muối tác dụng với dung dịch bazơ
Muối + Bazơ → Muối mới + Bazơ mới
Điều kiện: trong sản phẩm tạo thành phải có chất kết tủa hoặc chất bay hơi.
Ví dụ:
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
5. Phản ứng phân hủy muối
Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ:
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
CaCO3 ![]() CaO + CO2
CaO + CO2
II. Phản ứng trao đổi trong dung dịch
1. Định nghĩa phản ứng trao đổi
Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhay những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
2. Điều kiện xảy ra phản ứng trao đổi
Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan, chất khí hoặc nước.
Ví dụ:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
K2SO4 + NaOH: Phản ứng không xảy ra
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Chú ý:
– Phản ứng trung hòa cũng thuộc loại phản ứng trao đổi và luôn xảy ra.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
– Sự đổi màu của chất chỉ thị (Quỳ tím) khi tác dụng với dung dịch muối:
Hầu hết các phản ứng giữa axit-bazơ; axit-muối; bazơ-muối, muối-muối, muối-kim loại ,… đều là các phản ứng trao đổi.
+ Đối với phạm vi kiến thức THCS, các giáo viên thường giới thiệu muối chỉ làm quỳ tím không đổi màu. Tuy nhiên điều này chỉ đúng với một số muối như NaCl, Na2SO4, BaCl2, Ba(NO3)2, CaCl2.
Sau đây cô sẽ bổ sung cho các bạn một số thông tin như sau: Muối được cấu tạo từ gốc kim loại và gốc axit.
+ Muối được tạo từ gốc kim loại mạnh (Na, K, Ca, Ba) và gốc axit mạnh (Cl, SO4, NO3) thì không làm quỳ tính đổi màu.
Ví dụ:
NaCl, Na2SO4, BaCl2, Ba(NO3)2, CaCl2
+ Muối được tạo thành từ gốc kim loại mạnh (Na, K, Ca, Ba) và gốc axit yếu (CO3, SO3, PO4, S) thì quỳ tím hóa xanh.
Ví dụ:
Na2CO3, K2S, Na3PO4, CaS
+ Muối được tạo thành từ gốc kim loại tb-yếu (Al, Zn, Fe, Cu, …) và gốc axit mạnh (Cl, SO4, NO3) thì quỳ tím hóa đỏ.
Ví dụ:
FeCl3, AlCl3, ZnSO4, CuSO4,…
+ Muối được tạo thành từ gốc kim loại tb-yếu (Al, Zn, Fe, Cu, …) và gốc axit yếu (CO3, SO3, PO4, S) thì phụ thuộc vào từng trường hợp cụ thể.
III. Ví dụ bài tập về muối và phản ứng trao đổi
Ví dụ 1: Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:
a) Chất khí.
b) Chất kết tủa.
Viết các phương trình hóa học.
Hướng dẫn:
a) Tạo ra chất khí, ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3) hoặc dung dịch muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng):
CaCO3 + H2SO4 → CaSO4 + CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
b) Tạo chất kết tủa, ví dụ dung dịch muối (BaCl2, Ba(NO3)2,…) tác dụng với dung dịch H2SO4 tạo ra kết tủa trắng BaSO4.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Ba(NO3)2 + H2SO4 → BaSO4↓ + HNO3
– Hoặc những dung dịch muối bari tác dụng với dung dịch muối cacbonat (Na2CO3, K2CO3) tạo ra BaCO3 kết tủa trắng.
Ba(NO3)2 + Na2CO3 → BaCO3↓ + 2NaNO3.
Ví dụ 2: Có 3 lọ không nhãn, mỗi lọ đựng dung dịch muối sau: CuSO4, AgNO3, NaCl. Hãy dùng những dung dịch có sẵn trong phòng thí nghiệm để nhận biết chất đựng trong mỗi lọ. Viết các phương trình hóa học.
Hướng dẫn:
– Trích mẫu thử và đánh số thứ tự:
– Dùng dd NaCl có sẵn trong phòng thí nghiệm lần lượt cho vào từng mẫu thử trên:
+ Có kết tủa trắng xuất hiện đó là sản phẩm của AgNO3.
PTHH: NaCl + AgNO3 → AgCl↓ + NaNO3
+ Không có hiện tượng gì là CuSO4 và NaCl
– Dùng dung dịch NaOH có trong phòng thí nghiệm cho vào 2 mẫu còn lại:
+ Mẫu nào có kết tủa đó là sản phẩm của CuSO4.
PTHH: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
+ Còn lại là NaCl.
Ví dụ 3: Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Hãy cho biết muối nào có thể tác dụng với:
a) Dung dịch NaOH.
b) Dung dịch HCl.
c) Dung dịch AgNO3.
Nếu có phản ứng, hãy viết các phương trình hóa học.
Hướng dẫn:
a) Tác dụng với dung dịch NaOH là dung dịch các muối Mg(NO3)2 và CuCl2 vì sinh ra:
Mg(OH)2 kết tủa, Cu(OH)2 kết tủa.
Mg(NO3)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
b) Không muối nào tác dụng với dung dịch HCl.
c) Tác dụng với dung dịch AgNO3 là dung dịch muối CuCl2 tạo AgCl kết tủa trắng.
CuCl2 + 2AgNO3 → 2AgCl ↓ + Cu(NO3)2.
Sotayhoctap chúc các bạn học tốt!